~ 難治性リンパ腫の克服に向けたブレイクスルー ~
順天堂大学大学院医学研究科 血液内科学の安藤美樹 教授、原田早希子 助手、小松則夫 特任教授と東京大学医科学研究所 幹細胞治療部門の中内啓光 特任教授らの共同研究グループは、キメラ抗原受容体とT細胞受容体の2つの受容体を持ち、同時に2つの抗原を標的にできるiPSC(iPS細胞)由来2抗原受容体T細胞(Dual antigen receptor rejuvenated T cell; DRrejT)の作製に成功しました。この2つの受容体を持つDRrejTは1つの受容体しか持たない従来のT細胞に比べ、難治性の悪性リンパ腫に対して強力な抗腫瘍効果と生存期間延長効果を示すことを証明しました。さらに、DRrejTが生体内でメモリーT細胞として長期生存することも確認しました。これらの成果により、iPSC技術を活用したDRrejTは、難治性リンパ腫に対して迅速、高効率、かつ持続的な抗腫瘍効果を有し、画期的な治療法となる可能性があります。本研究は米国遺伝子細胞治療学会雑誌であるMolecular Therapy オンライン版に掲載されました。
本研究成果のポイント
キメラ抗原受容体(CAR)による抗原認識とT細胞受容体による抗原認識を両方兼ね備え、2つの異なる受容体により、効率よく腫瘍を攻撃するiPSC由来2抗原受容体T細胞(DRrejT)の作製に成功した。
DRrejTは1抗原を標的とするCART細胞または細胞傷害性T細胞に比べて、強力に難治性リンパ腫の増殖を抑制し、治療マウスの生存期間を有意に延長した。
DRrejTはマウス生体内でメモリーT細胞として長期生存することにより、リンパ腫細胞を再移植後も、T細胞の再投与なく腫瘍を排除した。
iPSC技術を活用することで、迅速に、何度でも、十分量のDRrejTを作ることが可能であり、“Off-the-shelf”療法として大いに期待できます。
背景
キメラ抗原受容体T細胞(CART)(注1)療法は、腫瘍微小環境(注2)にある難治性のがんを克服するために開発された遺伝子改変T細胞療法です。CD19抗原を標的にするCD19-CARTは再発難治の急性リンパ性白血病に90%近い寛解率をもたらし、大変有望ながん免疫療法となっています。しかしながら、長期観察では30%-50%の患者で再発することが課題となっており、その原因はCART細胞の疲弊と抗原陰性化であることがわかってきました。そこで研究グループは、2015年に末梢血エプスタイン・バール(EB)ウイルス(注3)抗原LMP2特異的細胞傷害性T細胞(CTL)からiPSCを樹立、分化誘導後、機能的に若返ったLMP2抗原特異的CTL(rejuvenated CTL; rejT)(注4)が、EBウイルス関連リンパ腫に対して強い抗腫瘍効果を持つことをマウスモデルで証明しました。
2020年には生体内でLMP2抗原特異的rejTが長期生存することにより、難治性リンパ腫の再発を防ぎ続けることを証明しました。本研究ではさらにこの手法を応用し、LMP2抗原特異的rejTにCARを搭載することで、2抗原を同時に標的にできる強力なDRrejTの作製を目指しました。そしてDRrejTが従来のCART療法の課題点を克服できるかを明らかにするため本研究を行いました。
内容
研究グループは、はじめにLMP2抗原特異的CTLクローンから樹立したiPSCに、EBウイルス抗原であるLMP1を標的とするLMP1-CARを導入後、LMP1-CAR-iPSCよりDRrejTを分化誘導しました。通常の末梢血T細胞にCARを遺伝子導入すると導入効率が30%程度でしたが、DRrejTでは100%の高いCAR導入効率を得ることができました。DRrejTはLMP2抗原に対しほぼ100%の抗原特異性を持つため、EBウイルス関連リンパ腫に対し、強力な細胞傷害活性を示すことが期待されます【図1】。次に細胞傷害活性を調べたところ、実際に100%LMP1-CARと100%LMP2抗原に対する抗原特異性を持つDRrejTは、1抗原のみを認識するLMP1-CARTもしくはLMP2-rejTに比較して、より高い細胞傷害活性を示しました。そして、DRrejTが生体内でどれぐらいの抗腫瘍効果を発揮するかを検証しました。免疫不全マウスに難治性のEBウイルス関連リンパ腫細胞株を腹腔内注射し、4日後に「DRrejT」もしくは「LMP2-rejT」を注射したところ、いずれも強い抗腫瘍効果を認められました。特に「DRrejT」では治療マウス全てが110日以上長期間生存していました。そこで、治療後の長期生存マウスにリンパ腫細胞を再移植したところ、新たにDRrejTを投与することなく、再移植したリンパ腫細胞を排除しました。このシステムの再現性を確かめるため、CD19-CARとLMP2抗原特異性の両方を兼ね備えるDRrejTも作製しました【図2】。この2抗原認識できるDRrejTは1抗原認識のCD19-CARもしくはLMP2-rejTに比較し、より強い腫瘍増殖抑制効果と生体内での強い耐久性が確認できました。
以上より、「DRrejT」は試験管内だけでなく、マウス生体内でも、CARとTCRの2つの受容体で同時に2抗原を標的とすることにより、迅速で協調的に抗腫瘍効果を示すことがわかりました。ひとつの抗原が陰性化しても、もうひとつの抗原を標的にできるメリットがあります。またiPSCから作ることによる若返りによって細胞の疲弊がなく、生体内でメモリーT細胞として(注5)長期生存可能な、何度でも十分量の治療用T細胞が手に入ることも大きな長所です。これにより従来のCART療法の課題を克服する結果を示すことができました。
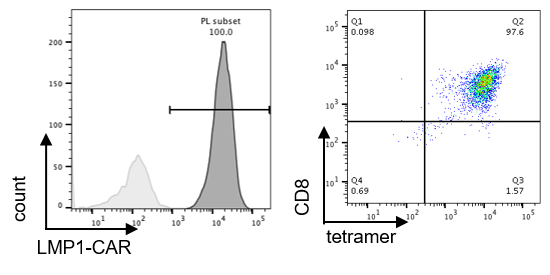 【図1】 DRrejTのCAR遺伝子導入効率とLMP2抗原特異性
【図1】 DRrejTのCAR遺伝子導入効率とLMP2抗原特異性
DRrejTのCAR遺伝子導入効率は、分化誘導後も100%であり(上図左)、更にLMP2抗原に対してほぼ100%の抗原特異性を保持した(上図右)。
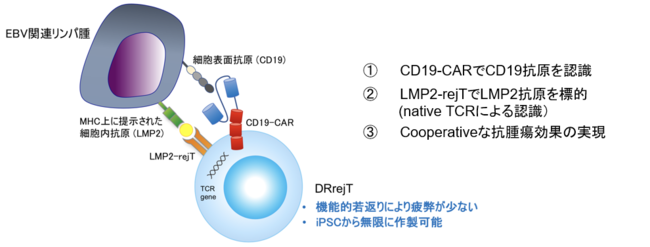 【図2】 本研究が提唱するDRrejTの概念図
【図2】 本研究が提唱するDRrejTの概念図
DRrejTは細胞表面抗原であるCD19抗原をCD19-CARで認識し、native TCRでLMP2抗原を認識できる。そのため協調的な抗腫瘍効果が実現する。
今後の展開
今回の研究により、健常人ドナー由来抗原特異的CTLクローンより作製したiPS細胞にCARを遺伝子導入することで、無限に増やすことができるDRrejTを作製することに成功しました。さらに、生体内での抗腫瘍効果と耐久性を持つことも確認しました。このDRrejTを用いた免疫療法の実用化に向け、実際に患者さんへの投与には免疫拒絶が起きないようにDRrejTのHLA抗原(注6)をゲノム編集する必要があります。現在開発中の免疫拒絶を回避する試みをより発展的に進め、多くの患者さんに適用できる“Off-the-shelf”療法になるよう研究を進めていく予定です。また今回はEBウイルス関連リンパ腫を標的にした治療モデルを作製しましたが、本手法を応用することで、難治性の固形がんに有効なDRrejTも期待できることから、がん治療のブレイクスルーとなるよう、更なる開発を進めています。
用語解説
(注1)キメラ抗原受容体: 腫瘍細胞表面に発現する抗原に対して特異的なモノクローナル抗体の軽鎖と重鎖を直列に結合させた一本鎖抗体と、T細胞受容体のζ鎖を人工的に繋げたキメラ抗原受容体。
(注2)腫瘍微小環境: 腫瘍組織とその周囲に混在する正常細胞、生体分子、血管などにより構成され、腫瘍の進行に大きな役割を果たしている。
(注3)エプスタイン・バール(EB)ウイルス: ヒトヘルペスウイルス科に属するウイルスの一種で、伝染性単核球症などの急性感染症を引き起こすのみならず、バーキットリンパ腫や上咽頭癌ではほぼ100%感染しており、ホジキンリンパ腫、NK細胞リンパ腫でも多くの症例で感染を認め、様々な腫瘍の発症に関わることが知られている。
(注4)機能的に若返ったiPSC由来抗原特異的細胞傷害性T細胞(rejuvenated CTL; rejT) : iPS細胞技術は細胞の若返り法の一つと言える。この手法を利用して腫瘍と反応する末梢血中のCTLからiPS細胞を作成し、再びCTLを分化させることにより、腫瘍を攻撃する若いCTL(rejT)を無限に供給することが可能になる。
(注5)メモリーT細胞: 抗原と出会う前のナイーブT細胞が抗原認識により活性化するとエフェクターT細胞となり、エフェクターT細胞の一部はメモリーT細胞として長期生存し次の抗原暴露に備える。2回目の抗原暴露があるとメモリーT細胞はすぐにエフェクターT細胞となり最初の抗原暴露に比較し早く効率よく反応できる。
(注6)HLA (Human Leukocyte Antigen) 抗原: 白血球にはABO血液型よりも複雑なヒト白血球抗原 (HLA:Human Leukocyte Antigen)と言われる型があり、造血幹細胞移植や免疫細胞療法の際の免疫反応に重要な役割を果たす。
原著論文
本研究は米国遺伝子細胞治療学会雑誌であるMolecular Therapy 誌オンライン版に2021年10月7日付けで先行公開されました。
論文タイトル:“Dual-antigen targeted iPSC-derived chimeric antigen receptor-T cell therapy for refractory lymphoma ”
論文タイトル(日本語訳):「難治性リンパ腫に対するiPS細胞由来2抗原標的キメラ抗原受容体T細胞療法」
著者: Sakiko Harada1, Miki Ando1,2*, Jun Ando1,3, Midori Ishii1, Tomoyuki Yamaguchi2, Satoshi Yamazaki3,4, Tokuko Toyota1, Kazuo Ohara1, Manami Ohtaka5, Mahito Nakanishi5, Chansu Shin6, Yasunori Ota7, Kazutaka Nakashima 8, Koichi Ohshima8, Chihaya Imai6, Yozo Nakazawa9, Hiromitsu Nakauchi2,10,11*, and Norio Komatsu1,11
著者(日本語表記):原田早希子1、安藤美樹1,2、安藤純1、石井翠1、山口智之2、山崎聡3,4、豊田釈子1 、小原和男1 、大高真奈美5、中西真人5、申将守6、大田泰徳7、中嶋一貴8、大島孝一8、今井千速6、中沢洋三9、中内啓光2,10、小松則夫1
所属:1順天堂大学医学部血液学講座、2東京大学医科学研究所幹細胞治療部門、3東京大学医科学研究所幹細胞治療研究センター幹細胞生物学分野、4筑波大学統合医科学研究部門幹細胞治療分野、5ときわバイオ株式会社、 6新潟大学医歯学系小児科学分野、7東京大学医科学研究所付属病院病理診断科、8久留米大学医学部病理学講座、9信州大学医学部小児医学教室、10スタンフォード大学医学部幹細胞生物学・再生医療研究所
DOI: https://doi.org/10.1016/j.ymthe.2021.10.006
本研究はJSPS科研費JP16K09842, JP19K07781の助成を受け実施されました。
また、本研究に協力頂きました健常人ドナーさまのご厚意に深謝いたします。